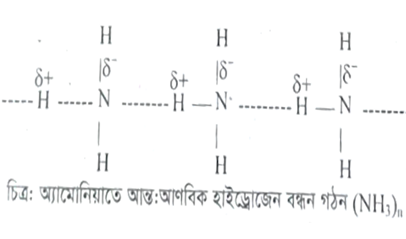
প্রশ্ন: তরল অবস্থায় NH3 অণুতে হাইড্রোজেন বন্ধন পরিলক্ষিত হলে HCl অণুতে হয় না-ব্যাখ্যা কর।
উত্তর: একটি ডাইপোলের H-প্রান্ত এবং অপর ডাইপোলের ঋণাত্মক প্রান্তের মধ্যে যে দুর্বল বন্ধন গঠিত হয় তাকে হাইড্রোজেন বন্ধন বলে।
H-পরমাণু অপেক্ষা N-পরমাণুর তড়িৎ ঋণাত্মকতা (H = 2.1, N = 3.0) বেশি হওয়ায় তরল NH3 অণুর আংশিক ধনাত্মক আধান প্রাপ্ত H- পরমাণুর, সঙ্গে অপর একটি NH3 অণুর আংশিক ঋণাত্মক আধান প্রাপ্ত N- পরমাণু আন্তঃআণবিক হাইড্রোজেন বন্ধন গঠন করে।এভাবে NH3 অণুগুলি আন্ত:আণবিক হাইড্রোজেন বন্ধন গঠনের মাধ্যমে বৃহদাকার (NH3)n অণু গঠন করে।
H পরমাণুর অপেক্ষা Cl পরমাণুর তড়িৎ ঋণাত্মকতা (H = 2.1, Cl = 3.0) বেশি হলেও, Cl পরমাণুর আকার বড় হওয়ার HCl-এর ক্ষেত্রে কার্যকর H-বন্ধন সৃষ্টি হয় না।
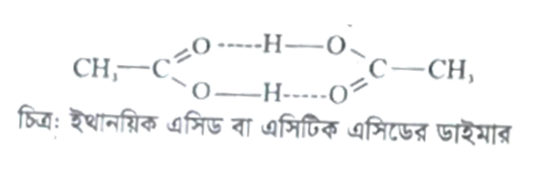
প্রশ্ন: ডাইমার কী? ইথানয়িক এসিড (অ্যাসিটিক এসিড) ডাইমার গঠন করে কেন? [ঢা.বো- ২১]
উত্তর: কোন যৌগের দুই অণু পরস্পর যুক্ত থাকলে তাকে ডাইমার বলে। ইথানয়িক এসিডের দুইটি অণু পরস্পরের সাথে যুক্ত থাকলে তাকে ইথানয়িক এসিডের ডাইমার বলে।
যখন দুইটি ইথানয়িক এসিডের অণু পরস্পরের কাছাকাছি আসে তখন প্রথম অণুর কার্বনিল মূলকের অক্সিজেন প্রান্ত এবং দ্বিতীয় অণুর হাইড্রোক্সিল মূলকের হাইড্রোজেন প্রান্তের মধ্যে হাইড্রোজেন বন্ধন সৃষ্টি হয়।
এভাবে দুইটি অণু দুইটি হাইড্রোজেন বন্ধন গঠনের মাধ্যমে পরস্পরের সাথে যুক্ত হয়ে ডাইমার গঠন করে।
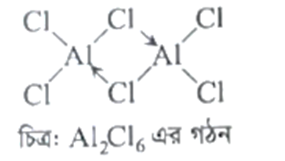
প্রশ্ন: নিম্ন তাপমাত্রায় AlCl3 গঠিত হয়-ব্যাখ্যা কর। [দি.বো-২১;ঢা.বো-১৯]
উত্তর: AlCl3 নিম্নতাপমাত্রায় ডাইমার (AlCl3) গঠন করে। অ্যালুমিনিয়াম ক্লোরাইড আয়নিক হলেও Al3+ আয়নের উচ্চ চার্জ ঘনত্বের কারণে অধিক মাত্রায় পোলারায়ন ঘটায় AlCl3 অণুটি সমযোজী প্রকৃতির হয়। অণুতে অষ্টক অপূর্ণ থাকে। একটি AlCl3 অণুর Al পার্শ্ববর্তী AlCl3 অণুর Cl পরমাণু থেকে মুক্ত ইলেকট্রন গ্রহণ করে এভাবে দুটি Al ← Cl সন্নিবেশ বন্ধন গঠনের মাধ্যমে ডাইমার গঠিত হয়। এভাবে Al পরমাণু তার অষ্টক পূর্ণ করে।
প্রশ্ন : ইথানল বা অ্যালকোহল পানিতে দ্রবণীয় কিন্তু ইথেন পানিতে অদ্রবণীয়, ব্যাখ্যা কর।
উত্তর : অ্যালকোহলে – OH মূলকের হাইড্রোজেন পরমাণুর তুলনায় অক্সিজেন পরমাণুর তড়িৎ ঋণাত্মকতা বেশি হওয়ায় অক্সিজেন পরমাণু আংশিক ঋণাত্মক এবং হাইড্রোজেন পরমাণু আংশিক ধনাত্মক চার্জে পরিণত হয়। এ কারণে অ্যালকোহলসমূহ নিজেদের মধ্যে এবং পানির অণুর সাথে হাইড্রোজেন বন্ধন গঠন করতে পারে। এ কারণে অ্যালকোহল পানিতে দ্রবীভূত হয়।
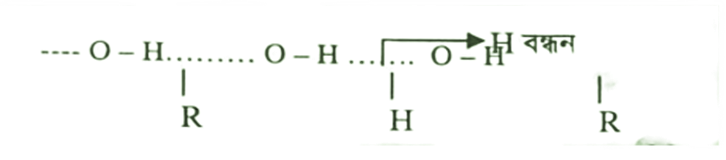
অপরদিকে, ইথেন পানির অণুর সাথে হাইড্রোজেন বন্ধন গঠন করতে পারে না। এ কারণে অ্যালকোহল পানিতে দ্রবীভূত হয় কিন্তু ইথেন পানিতে দ্রবীভূত হয় না।
প্রশ্ন: অর্থো নাইট্রোফেনল ও প্যারা নাইট্রোফেনল এর গলনাংক ভিন্নতার কারণ ব্যাখ্যা কর ।
উত্তর : অর্থো নাইট্রোফেনলে একই অণুর দুটি পোলার গ্রুপের মধ্যে হাইড্রোজেন বন্ধন সৃষ্টি হয় একে অন্তঃআণবিক হাইড্রোজেন বন্ধন বলে। অর্থো নাইট্রোফেনলে হাইড্রোজেন বন্ধন একই অণুর মধ্যে বিদ্যমান থাকায় আণবিক ভর তুলনামূলক ভাবে কম। এ কারণে এর গলনাংক কম (45°C) হয়।
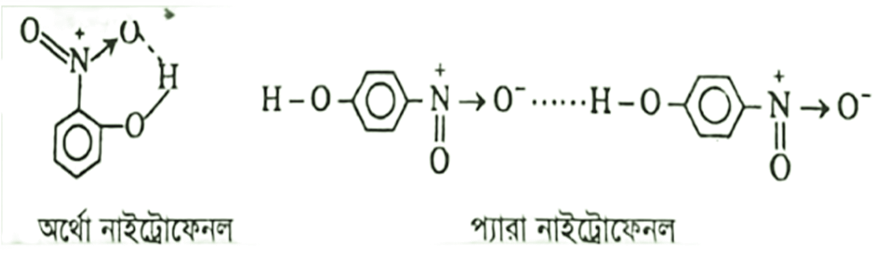
অপর দিকে প্যারা নাইট্রোফেনলে দুটি অণুর মধ্যে আন্তঃআণবিক হাইড্রোজেন বন্ধন বিদ্যমান থাকায় এর অণুসমূহ পরস্পরের সাথে আকৃষ্ট থাকে ফলে আকারে বড় হয়। ফলে অণুসমূহকে বিচ্ছিন্ন করতে অতিরিক্ত শক্তির প্রয়োজন হয় বলে এদের গলনাংক (114°C) বেশি হয়। তাই অর্থোনাইট্রোফেনলের চেয়ে প্যারা নাইট্রোফেনলের গলনাংক বেশি।
প্রশ্ন: কক্ষ তাপমাত্রায় H2O তরল কিন্তু H2S গ্যাসীয়, ব্যাখ্যা কর।
[য.বো, সি.বো, মা.বো, চ.বো, ঢা.বো-২১; মা.বো-১৮; কু.বো-১৫, য.বো-১৬: ঢা.বো, সি. বো, রা .বো-১৭; য.বো-১৯]
উত্তর: H2O ও H2S একই গঠন বিশিষ্ট সমযোজী যৌগ হওয়া সত্ত্বেও কক্ষ তাপমাত্রায় H2S গ্যাসীয় কিন্তু H2O একটি তরল পদার্থ । এর কারণ নিম্নরূপ:
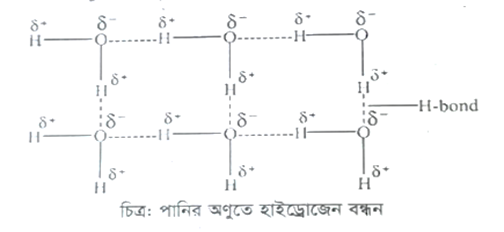
পানিতে অক্সিজেন পরমাণুর তড়িৎঋনাত্মকতা (3.5) হাইড্রোজেন পরমাণুর (2.1) তুলনায় অনেক বেশি বলে এদের বন্ধন ইলেকট্রনযুগল অক্সিজেন পরমাণু তার নিজের দিকে টেনে নেয়। এতে অক্সিজেন পরমাণুটি আংশিক ঋনাত্মক চার্জ এবং হাইড্রোজেন পরমাণুটি আংশিক ধনাত্মক চার্জ লাভ করে।
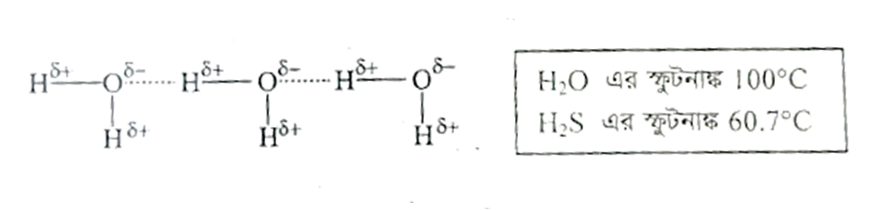
এইরূপ অসংখ্য পানির অণু পরস্পরের সান্নিধ্যে এলে H-বন্ধন গঠনের মাধ্যমে বৃহৎ আনবিক গুচ্ছ সৃষ্টি করে। এই H-বন্ধন গঠিত হবার কারণে অণুগুলোর মধ্যে আন্তঃআনবিক আকর্ষণ বল বৃদ্ধি পায়। এ কারনে সাধারণ তাপমাত্রায় পানি তরল।
পক্ষান্তরে H2S এ H (2.1) ও S (2.5) এর মধ্যে তড়িৎঋনাত্মকতার পার্থক্য কমবলে সাধারণত ডাইপোলের সৃষ্টি হয় না ফলে H বন্ধন গঠিত হয়না। ফলে অণু সমূহের মধ্যে আন্তঃআনবিক আকর্ষণ বল কম হয়। ফলে এরা বিচ্ছিন্ন অবস্থায় থাকে। এ কারনে সাধারণ তাপমাত্রায় H2S গ্যাসীয়।
প্রশ্ন: H2O ও HF উভয় ক্ষেত্রে H-বন্ধন পরলক্ষিত হলেও HF অপেক্ষা H2O এর স্ফুটনাঙ্ক বেশি ব্যাখ্যা কর।
উত্তর: HF এর অনুতে Hও F এর তড়িৎ ঋনাত্মকতার পার্থক্য বেশী (4.0 – 2.1 = 1.9) হওয়ায় ডাইপোল সৃষ্টি হয়। এই ডাইপোল সমূহ হাইড্রোজেন বন্ধন গঠনের মাধ্যমে যুক্ত হয়ে বিরাট আণবিক গুচ্ছ তৈরী করে।
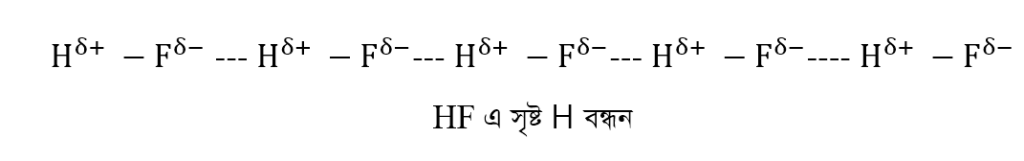
H2O এর অণুতে H ও O এর তড়িৎ ঋনাত্মকতার পার্থক্য বেশি (3.5 – 2.1 = 1.4) হওয়ায় ডাইপোল সৃষ্টি হয় এবং অসংখ্য পানির অণু পরস্পরের সাথে H-বন্ধনের মাধ্যমে যুক্ত থাকে। একটি পানির অণু অপর 4 টি পানির অণুর সাথে H বন্ধনে অংশগ্রহণ করে। কিন্তু একটি HF অণু অপর দুটি HF অণুর সাথে H বন্ধনে অংশগ্রহন করে। তাই HF এর তুলনায় পানিতে অণুসমূহের মধ্যে H-বন্ধনের মাত্রা বেশি। পানিতে অণুসমূহ অধিক সংযোজিত অবস্থায় থাকে। এক্ষেত্রে অণুসমূহকে বিচ্ছিন্ন করতে অধিক তাপ শক্তির দরকার হয়। এ কারণে পানির স্ফুটনাঙ্কের মান 100°C হলেও HF এর স্ফুটনাঙ্কের মান মাত্র 19.5°C। অর্থাৎ HF অপেক্ষা H2O এর স্ফুটনাঙ্ক বেশি।
প্রশ্ন: H2S অম্লধর্মী, কিন্তু H2O নিরপেক্ষ-কারণ কী?
উত্তর: S পরমাণু O পরমাণু অপেক্ষা আকারে বড় হওয়ায় S-H বন্ধন O-H বন্ধন অপেক্ষা দৈর্ঘ্য বড়, ফলে S-H বন্ধন O-H বন্ধন অপেক্ষা দুর্বল। জলীয় দ্রবণে দুর্বল S-H বন্ধন সহজে বিয়োজিত হয়ে H+ আয়ন উৎপন্ন করে, কিন্তু অপেক্ষাকৃত শক্তিশালী O-H বন্ধনের বিয়োজন সহজে ঘটে না। তাই H2S অম্লধর্মী, কিন্তু H2O নিরপেক্ষ।
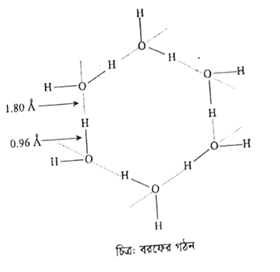
প্রশ্ন: বরফ পানিতে ভাসে কেন?
উত্তর: বরফের কেলাসে প্রতিটি অক্সিজেন পরমাণু চারিদিকে চারটি হাইড্রোজেন পরমাণুর সাথে যুক্ত হয়ে চতুস্তলকীয় গঠন কাঠামো সৃষ্টি করে। এর মধ্যে দুটি সমযোজী বন্ধন এবং বাকী দুটি H -বন্ধন। সমযোজী বন্ধনের তুলনায় H- বন্ধনের দৈর্ঘ্য বড় হওয়ায় বরফে H2O অণুগুলো তুলনায় দূরে দূরে অবস্থান করে। অসংখ্যা H -বন্ধন গঠনের মাধ্যমে বরফের কেলাসে হেক্সাগোনাল ফাঁকা স্থানের সৃষ্টি হয়। তাই তরল পানির বরফের আয়তন বেশি এবং ঘনত্ব কম হয়। তাই বরফ পানিতে ভাসে।