পোলারায়ন : যখন কোনো ক্যাটায়ন একটি অ্যানায়নের খুব নিকটে আসে, তখন ক্যাটায়নের নিউক্লিয়াস তথা সামগ্রিক ধনাত্মক চার্জ অ্যানায়নের ইলেকট্রন মেঘকে নিজের দিকে আকর্ষণ করে। একই সাথে ক্যাটায়নটি অ্যানায়নের নিউক্লিয়াসকে বিকর্ষণ করে। এ আকর্ষণ ও বিকর্ষণের ফলে অ্যানায়নের ইলেকট্রন মেঘ ক্যাটায়নের দিকে সরে আসে। একে ক্যাটায়ন দ্বারা অ্যানায়নের বিকৃতি বা পোলারায়ন বলা হয়। তখন ক্যাটায়ন দ্বারা অ্যানায়নটি পোলারায়িত হয়েছে বলা হয়। অ্যানায়নকে এভাবে পোলারায়িত করার ক্ষমতাকে ক্যাটায়নের পোলারায়ন ক্ষমতা বলে।

আয়নিক যৌগে সমযোজী বৈশিষ্ট্য (Covalent Character in Ionic Compounds)
অ্যানায়নে পোলারায়ন নিঃসন্দেহে আদর্শ আয়নিক যৌগের ধর্ম থেকে বিচ্যুতি। এ কারণে পোলারায়নের পরিমাণ বৃদ্ধির সাথে সাথে আয়নিক যৌগের বিভিন্ন ধর্মের (যেমন: উচ্চ গলনাঙ্ক, উচ্চ ফুটনাঙ্ক, উদ্বায়িতা, পানিতে অধিক দ্রবণীয়তা প্রভৃতির) হ্রাস ও সমযোজী যৌগের বৈশিষ্ট্যের ক্রম বৃদ্ধি ঘটে। ধাতব কার্বনেট লবণসমূহে অধিক পোলারায়ন ঘটলে এদের সুস্থিতি হ্রাস পায় এবং অল্প তাপে বিয়োজিত হয়।
ফাজানের নিয়ম : আয়নিক যৌগে ক্যাটায়ন দ্বারা অ্যানায়নের পোলারায়নের পরিমাণ কয়েকটি শর্ত যেমন: আয়নের চার্জ, আয়নের আকার ও আয়নের ইলেকট্রন বিন্যাস ইত্যাদি দ্বারা নির্ধারিত হয়। এ সব শর্তকে ফাজানের পোলারায়ন নিয়ম বলা । এ সব শর্তের ভূমিকা হলো:
(i) ক্যাটায়নের ও অ্যানায়নের চার্জের পরিমাণ যত বেশি হয় পোলারায়ন ততো বেশি হয়।
(ii) ক্যাটায়নের আকার যতো ছোট হয় এবং অ্যানায়নের আকার যতো বড় হয় পোলারায়ন ততো বেশি ঘটে। এছাড়া
(iii) যে সব ক্যাটায়নের ইলেকট্রন বিন্যাসে ns2 np6 ndl-10 ইলেকট্রন বিন্যাস থাকে; সে সব ক্ষেত্রে ns2 2p6 এর তুলনায় অ্যানায়নের বিকৃতি বা পোলারায়ন বেশি মাত্রায় ঘটে। যেমন:
ফাজানের পোলারায়ন নিয়ম বা শর্তাবলির ব্যাখ্যা:
পোলারায়নের ১ম নিয়ম :
ক্যাটায়ন ও অ্যানায়নের চার্জের পরিমাণ : কোনো ক্যাটায়ন কর্তৃক অ্যানায়নকে পোলারায়ন করার ক্ষমতা ক্যাটায়নের ধনাত্মক চার্জ বৃদ্ধির সাথে বৃদ্ধি পায়।
পর্যায়ভিত্তিক সম্পর্ক : পর্যায় সারণির যে কোনো পর্যায়ে বাম দিক থেকে যতোই ডান দিকে যাওয়া যায়, ক্যাটায়নসমূহের ধনাত্মক চার্জও ততো বৃদ্ধি পায় । ফলে অধিক চার্জযুক্ত ক্যাটায়নের পোলারায়ন ক্ষমতাও ততোই বৃদ্ধি পায়। ফলে যৌগটিতে সমযোজী বৈশিষ্ট্য বৃদ্ধি পায়। তাই সংশ্লিষ্ট যৌগের গলনাঙ্ক হ্রাস পায়।
তৃতীয় পর্যায়ে Na+আয়ন এর চেয়ে Mg2+ আয়নের পোলারায়ন ক্ষমতা বেশি। Mg2+ আয়ন অপেক্ষা Al3+ আয়নে পোলারায়ন ক্ষমতা আরো বেশি। তাই এসব আয়নের যৌগসমূহে সমযোজী ধর্ম ক্রমানুসারে বৃদ্ধি পায় এবং যৌগসমূহে গলনাঙ্ক এবং স্ফুটনাঙ্ক ক্রমশ হ্রাস পায়। যেমন: NaCl (গলনাঙ্ক 801°C) > MgCl2 (গলনাঙ্ক 714°C) > AICl3 (গলনাঙ্ক 190°C)।
আবার,
একই ধাতব পরমাণু বিভিন্ন চার্জযুক্ত ক্যাটায়ন সৃষ্টি করলে কম চার্জবিশিষ্ট ক্যাটায়নের পোলারায়ন ক্ষমতা কম হবে এবং বেশি চার্জের ক্যাটায়নের পোলারায়ন ক্ষমতা বেশি হবে। যেমন, অনার্দ্র ফেরাস ক্লোরাইড (FeCl2)। গলনাঙ্ক 670°C অথচ অনার্দ্র ফেরিক ক্লোরাইড (FeCl3) এর গলনাঙ্ক মাত্র 306°C। ফেরিক ক্লোরাইড FeCl3ক্যাটায়নের চার্জ এক একক বৃদ্ধি পাওয়ায় যৌগের সমযোজী ধৰ্ম বৃদ্ধি পায়। ফলে গলনাঙ্ক কমে।
আবার,
অ্যানায়নসমূহের ঋণাত্মক চার্জের বৃদ্ধির সাথে পোলারায়িত হওয়ার প্রবণতা বৃদ্ধি পায়। যেমন, ফ্লোরাইড (F–)আয়ন অপেক্ষা অক্সাইড (O2-)আয়ন বেশি পোলারায়িত হয় এবং নাইট্রাইড (N3–) আয়ন আরও বেশি পোলারায়িত হয়। ফলে CaF2 অপেক্ষা CaO অধিক সমযোজী প্রকৃতির হয়।
পোলারায়নের ২য় নিয়ম :
ক্যাটায়ন ও অনায়নের আকার : কোনো ক্যাটায়নের অ্যানায়নকে পোলারায়ন করার ক্ষমতা এর আকার হ্রাসের সাথে বাড়ে। পর্যায় সারণিতে একই গ্রুপে যতোই নিচ থেকে ওপরের দিকে যাওয়া যায় একই চার্জযুক্ত কাটায়নসমূহের আকার কমে যাওয়ায় এদের পোলারায়ন ক্ষমতাও বেড়ে যায়, অর্থাৎ এ সব সব আয়নের যৌগসমূহের সমযোজী ধর্ম ততো বাড়ে।
গ্রপ-2(2A) এর দ্বিধনাত্মক চার্জযুক্ত বিভিন্ন ক্যাটায়নের ব্যাসার্ধ ঐ গ্রুপের নিচ থেকে ওপর দিকে কমতে থাকে । যেমন:
Ba2+ = 1.34 Å, Sr2+ = 1.12 Å, Ca2+ = 0.99 Å, Mg2+ = 0.66 Å, Be2+ = 0.35 Å
তাই তাদের পোলারায়ন ক্ষমতা বিপরীতভাবে কমে : যেমন: Be2+> Mg2+ > Ca2+ > Sr2+> Ba2+
তাদের অনার্দ্র ক্লোরাইডসমূহের সমযোজী বৈশিষ্ট্যের বৃদ্ধি বা গলনাঙ্কের হ্রাসের ক্রম হলো নিম্নরূপ :
BaCl2 (963°C) > SrCl2 (875°C) > CaCl2 (782°C) > MgCl2 (714°C) > BeCl2 (405°C)
আবার
অ্যানায়নের আকার বৃদ্ধির সাথে পোলারায়িত হওয়ার প্রবণতা বৃদ্ধি পায়। অ্যানায়নের ব্যাসার্ধ বৃদ্ধি পেলে সর্ববহিস্থ স্তরের ইলেক্ট্রনের সাথে নিউক্লিয়াসের গড় দূরত্ব বৃদ্ধি পায়। ফলে ইলেকট্রনের ওপর অ্যানায়নের নিউক্লিয়াসের আকর্ষণ হ্রাস পায়। তখন ক্যাটায়ন সহজেই অ্যানায়নকে পোলারায়িত করতে পারে। একই গ্রুপে ওপর থেকে নিচের দিকে অনায়নের পোলারায়িত হওয়ার প্রবণতা বাড়ে। যেমন:
F– (133 pm) < Cl– (181 pm) < Br– (196 pm) < I– (220 pm)
ক্যালসিয়ামের হ্যালাইডসমূহের মধ্যে CaI2 এ সমযোজী বৈশিষ্ট্য সবচেয়ে বেশি। এদের গলনাঙ্ক নিম্নরূপ :
CaF2 = 1392°C, CaCl2 = 782°C, CaBr2 = 730°C, Cal2 = 575°C
অনুরূপভাবে সোডিয়াম হ্যালাইডসমূহের আয়নিক ধর্মের হ্রাসক্রম হলো: NaF > NaCl> NaBr> Nal
অনুরূপভাবে সোডিয়াম হ্যালাইডসমূহের সমযোজী ধর্মের বৃদ্ধিক্রম হলো: NaF < NaCl <NaBr < Nal
পোলারায়নের ৩য় নিয়ম :
ক্যাটায়নের ইলেকট্রন বিন্যাস : সমচার্জের ও প্রায় সমআকারের দুটি ক্যাটায়নের মধ্যে ns2np6 ইলেক্ট্রন বিন্যাসবিশিষ্ট ক্যাটায়ন অপেক্ষা ns2np6(n -1)dl0 বিশিষ্ট ক্যাটায়নের নিউক্লিয়াসে থাকা অধিক সংখ্যক প্রোটনের অধিক আকর্ষণের কারণে পোলারায়ন ক্ষমতা বেশি হয়। যেমন: NaCl এর গলনাঙ্ক 801°C, অথচ কপার (I) ক্লোরাইড CuCl এর গলনাঙ্ক মাত্র 422°C যা দ্বারা শেষোক্ত যৌগে সমযোজী ধর্মের প্রাধান্য বোঝা যায়। যদিও Na+ (0.095 nm) ও Cu+ (0.096 nm) এর আকার প্রায় সমান।
পোলারিটি ও পোলারায়ন-এর মধ্যে পার্থক্য কী?
পোলারিটি ও পোলারায়ন এ উভয় পদের মধ্যে সংজ্ঞা ও বৈশিষ্ট্যভিত্তিক নিম্নোক্ত পার্থক্য রয়েছে।
১. (ক) পোলারিটির সংজ্ঞা : সমযোজী যৌগ অণুর সংশ্লিষ্ট দুই পরমাণুর তড়িৎ ঋণাত্মকতার পার্থক্য 0.5-19 এর মধ্যে হলে তখন অধিক তড়িৎ ঋণাত্মক পরমাণুর দিকে সমযোজী বন্ধন ইলেকট্রন যুগল বেশি আকৃষ্ট হয়ে থাকে। ফলে অণুর দুই প্রান্তে দুটি আংশিক ভিন্ন চার্জযুক্ত মেরু সৃষ্টি হয়। এক্ষেত্রে উভয় ভিন্ন মেরুকে ডাইপোল এবং সমযোজী যৌগের অণুতে ডাইপোল সৃষ্টি ধর্মকে পোলারিটি বলে। এরূপ যৌগকে পোলার অণু বলে। যেমন HF ও H2O হলো পোলার অণু।
(খ) পোলারায়নের সংজ্ঞা : যখন কোনো ক্যাটায়ন একটি আ্যানায়নের খুব নিকটে আসে, তখন ক্যাটায়নের নিউক্লিয়াস বা সামগ্রিক ধনাত্মক চার্জ অ্যানায়নের ইলেকট্রন মেঘকে নিজের দিকে আকর্ষণ করে। একই সাথে ক্যাটায়নটি অনায়নের নিউক্লিয়াসকে বিকর্ষণ করে। এরূপ আকর্ষণ ও বিকর্ষণের ফলে অ্যানায়নের ইলেকট্রন মেঘ ক্যাটায়নের দিকে সরে আসে। আয়নিক যৌগে ইলেকট্রন মেঘের এরূপ অবস্থাকে ক্যাটায়ন দ্বারা অ্যানায়নের পোলারায়ন বলে।
২. পোলারিটি ও পোলারায়নের বৈশিষ্ট্য বা ফলাফল :
(ক) পোলারিটি সৃষ্টির ফলে সমযোজী যৌগের মধ্যে আংশিক আয়নিক যৌগের বা তড়িৎযোজী যৌগের ধর্ম প্রকাশ পায়। যেমন HCl, HNO3, H2SO4 ইত্যাদি সমযোজী যৌগ পানিতে সহজে আয়নিত হয়ে থাকে। এসব পোলার যৌগের জলীয় দ্রবণ তড়িৎ বিশ্লেষ্য হয়ে থাকে; ফলে বিদ্যুৎ পরিবহন করতে পারে।
পোলারায়নের ফলে আয়নিক যৌগ বা তড়িৎডোজী যৌগের মধ্যে আংশিক সমযোজী যৌগের ধর্ম প্রকাশ পায়। এর ফলে যৌগের গলনাঙ্ক, পানিতে দ্রাব্যতা, কার্বনেট লবণের তাপীয় স্থিতি ইত্যাদি প্রতি ক্ষেত্রে হ্রাস পায়। যেমন NaCl এর 801°C কিন্তু পোলারায়নের প্রভাবে AlCl3 এর গলনাঙ্ক হ্রাস পেয়ে 190°C হয়।
আয়নিক বিভব বা আয়নিক পটেনসিয়াল (Ionic Potential)
ফাজানের পোলারায়ন নিয়ম মতে, ক্যাটায়ন দ্বারা অ্যানায়নকে পোলারায়ন করার ক্ষমতা ক্যাটায়নের চার্জ বৃদ্ধির সাথে বাড়ে এবং ক্যাটায়নের ব্যাসার্ধ বৃদ্ধির সাথে কমে। বিভিন্ন ক্যাটায়নের পোলারায়ন ক্ষমতা তুলনা করার জন্য “আয়নিক পটেনসিয়াল’ পদ ব্যবহৃত হয় :

ক্যাটায়নের আয়নিক পটেনসিয়ালের মান বৃদ্ধির সাথে-
(i) আয়নিক লবণের গলনাঙ্ক ও স্ফুটনাঙ্ক ক্রম হ্রাস পায়
(ii) লবণের পানিতে দ্রাব্যতা হ্রাস পায়,
(iii) যৌগসমূহ বর্ণযুক্ত হয়,
(iv) ধাতব কার্বনেটসমূহের অল্প তাপে বিয়োজন ঘটে
(১) পানিতে লবণের দ্রাব্যতা হ্রাস :
আয়নিক যৌগসমূহ পোলার দ্রাবক পানিতে দ্রবণীয়; কিন্তু সমযোজী যৌগ পানিতে সাধারণত কম দ্রবণীয় বা অদ্রবণীয় হয়। আয়নিক যৌগে অ্যানায়ন খুব বেশি পোলারায়িত হলে যৌগটির সমযোজী ধৰ্ম বৃদ্ধি পায়। অ্যানায়নের আকার বৃদ্ধির সাথে পোলারায়িত হওয়ার প্রবণতা বৃদ্ধি পায়। ফলে সে যৌগ পানিতে অদ্রবণীয় হয়। যেমন: AgF, AgCl, AgBr ও AgI এ চারটি যৌগের মধ্যে AgF এ অ্যানায়নের পোলারায়ন সবচেয়ে কম ঘটে। কারণ F– আয়নের আকার সবচেয়ে ছোট। তাই AgF এ আয়নিক বৈশিষ্ট্য বেশি থাকে এবং এটি পানিতে দ্রবণীয়; অন্য হ্যালাইডসমূহে অ্যানায়নের পোলারায়ন বেশি ঘটে; তাই এরা পানিতে অদ্রবণীয় হয়।
যৌগের বর্ণ : সাধারণত d ও f অরবিটালে অযুগ্ম ইলেকট্রনবিশিষ্ট আয়নের যৌগসমূহ বর্ণযুক্ত হয়। যৌগের বর্ণযুক্ত হওয়ার অন্যতম কারণ হলো অ্যানায়নের বেশি পোলারায়ন। অক্সাইড, সালফাইড প্রভৃতি আয়নের পোলারায়িত হওয়ার প্রবণতা বেশি। ক্যাটায়ন যেমন Hg2+ , Cu2+ Cd2+, Pb2+ প্রভৃতির সাথে উপরিউক্ত অ্যানায়নসমূহের যৌগে অ্যানায়নসমূহ খুব বেশি পোলারায়িত হয়; ফলে এ সব যৌগ বর্ণযুক্ত হয়। যেমন: CuS, PbS, HgS কালো, CdS হলুদ।
AgF, AgCl, AgBr ও AgI সিরিজে Ag+ আয়নের পোলারায়ন ক্ষমতা বেশি। হ্যালাইড আয়নসমূহের মধ্যে F– ও Cl– আয়ন কম পোলারায়িত হয় তাই AgF, AgCl বর্ণহীন বা সাদা Br– আয়ন বেশি পোলারায়িত হওয়ায় AgBr হালকা হলুদ। আয়োডাইড (I–) আয়ন আরও বেশি পোলারায়িত হওয়ায় AgI গাঢ় হলুদ হয়। পোলারায়িত অবস্থায় বর্ণ সৃষ্টির মূল কারণ হলো অ্যানায়নের আকার বৃদ্ধির সাথে পোলারায়ন যেমন সহজে ঘটে, তেমনি আয়নের পূর্ণ অরবিটাল থেকে ক্যাটায়নের খালি করা অরবিটালে ইলেকট্রনের ক্ষণিক স্থানান্তর সহজে ঘটে থাকে তখন প্রয়োজনীয় কম শক্তি দৃশ্যমান আলো থেকে শোষিত হয় এবং অবশিষ্ট আলোর বর্ণে যৌগটি বর্ণয়,অ্যানায়নের আকার ছোট হলে পোলারায়ন কম ঘটে । তখন ঐ ছোট অ্যানায়ন থেকে ক্যাটায়নের দিকে ইলেট্রন স্থানান্তর (যা বিস্তারণ বা লন্ডন বল নামে পরিচিত) ঘটানোর জন্য অপেক্ষাকৃত বেশি শক্তি প্রয়োজন হয় ফ্রিকুয়েন্সি যুক্ত UV রশ্মি থেকে শক্তি শোষিত হয় এবং যৌগটি বর্ণহীন বা সাদা দেখায়।
যেমন: AgCl হলুদ HgCl সাদা, কিন্তু HgI2 লাল; PbCl2 সাদা, কিন্তু Pbl2 সোনালি হলুদ হয়ে থাকে।
(৩) ধাতব কার্বনেটের তাপীয় স্থিতি : ক্যাটায়নের আয়নিক পটেনসিয়াল বেশি হলে তখন কাৰ, ইলেকট্রন মেঘ ক্যাটায়ন দ্বারা বেশি আকৃষ্ট হয়। তখন কার্বনেট লবণের তাপীয় স্থিতি হ্রাস পায়। ফলে অল্প লবণ বিয়োজিত হয়ে ধাতব অক্সাইড ও CO2 উৎপন্ন করে। যেমন:
গ্রুপ-2 এর ধাতব আয়ন (M2+) সমূহের আয়নিক পটেনসিয়াল এদের আকার বৃদ্ধির সাথে গ্রুপের ওপর দিকে কমে। যেমন, Be2+ > Mg2+ > Ca2+ > Sr2+ > Ba2+ তাই এসব ক্যাটায়নের কার্বনেটের স্থিতি তথা যৌগের গলনাঙ্ক একই ক্রমানুসারে বাড়তে থাকে। অর্থাৎ এদের বিয়োজন তাপমাত্রা ক্রমশ বাড়তে থাকে। যেমন: BeCO3 = 100°C, MgCO3 = 350°C, CaCO3 = 547°C, SrCO3 = 778°C, BaCO3 = 998°C,
মৌলের কর্ণ সম্পর্ক (Diagonal Relationship of the Elements)
পর্যায় সারণির দ্বিতীয় পর্যায়ভুক্ত বিভিন্ন গ্রুপের মৌলসমূহের কিছু পর্যায়বৃত্ত ধর্ম একই গ্রুপভুক্ত মৌলের চেয়ে পত্র তৃতীয় পর্যায়ভুক্ত তাদের ডানদিকের মৌলের সাথে অর্থাৎ কোনাকুনিভাবে অবস্থিত মৌলের ধর্মের সাথে অধিকতর মিল দেখা যায়। এ দুটি পর্যায়ের মধ্যে কোনাকুনি অবস্থানের দুটি মৌলের ধর্মের সাদৃশ্যকে মৌলের কর্ণ সম্পর্ক বলে। যেমন:
দ্বিতীয় পর্যায়ভুক্ত গ্রুপ-1 (বা 1A) এর মৌল Li এর সাথে তৃতীয় পর্যায়ভুক্ত গ্রুপ-2 (বা 2A) এর মৌল Mg এর ধর্মে যথেষ্ট সাদৃশ্য দেখা যায়। অনুরূপভাবে Be এর সাথে Al এবং B এর সাথে Si এর ধর্মে বেশ সাদৃশ্য রয়েছে। তাদের নিম্নরূপে দেখানো হয়।
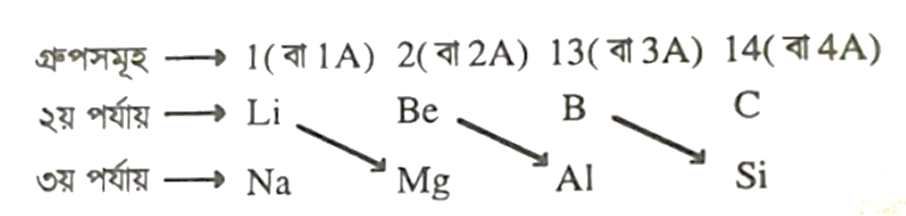
কর্ণ সম্পর্কিত মৌলসমূহ (Li ও Mg, Be ও Al, B ও Si) এর ধর্মে সাদৃশ্যের কারণ :
(১) আয়নিক ব্যাসার্ধ : প্রতি জোড়া মৌলের পরমাণুর আয়নিক ব্যাসার্ধ খুব কাছাকাছি হয়। যেমন:
Li = 0.068 nm Mg2+ = 0.078 nm, Be2+ = 0.034 nm, A13+ = 0.050 nm
(২) আয়নীকরণ শক্তি : তাদের আয়নীকরণ শক্তির পরিমাণ প্রায় কাছাকাছি। যেমন, Li ও Mg এর ১ম আয়নীকরণ। শক্তির মান যথাক্রমে 520 kJmol-1 ও 738 kJmol-1 | Be ও Al এর ১ম আয়নীকরণ শক্তি যথাক্রমে 899 kJmol-1 ও 578 kJmol-1 |
(৩) তড়িৎ ঋণাত্মকতা : তাদের তড়িৎ ঋণাত্মকতার পার্থক্য খুব কম। যেমন, Li ও Mg এর তড়িৎ ঋণাত্মকতার মান যথাক্রমে 1.0 ও 1.2। Be ও Al এর তড়িৎ ঋণাত্মকতা হলো যথাক্রমে 1.5 ও 1.5।
(৪) পোলারিকরণ ক্ষমতা : তাদের পোলারিকরণ ক্ষমতা প্রায় সমান হয়।
(৫) আয়নিক চার্জের ঘনত্ব : তাদের আয়নিক চার্জের ঘনত্ব পরস্পরের কাছাকাছি।