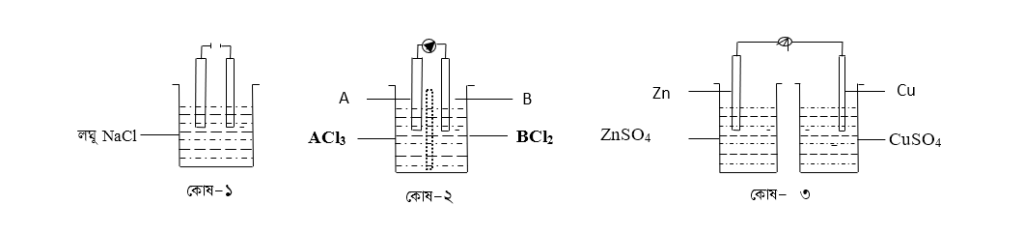
g) কোষ-২ এবং কোষ-৩ এর মধ্যে তড়িৎ উৎপাদনে কোনটি অধিক কার্যকর-এরং কেন ব্যাখ্যা করো ।
h) কোষ-১ এর কৌশল ব্যাবহার করে কপার বিশুদ্ধকরণ এবং তড়িৎ প্রলেপন প্রক্রিয়া ব্যাখ্যা করো।
(g) নং প্রশ্নের উত্তর:-
কোষ-২ একটি তড়িৎ-রাসায়নিক কোষ (Electrochemical cell) এর গঠন বিক্রিয়া নিম্নরুপ:
যে বৈদ্যুতিক কোষে রাসায়নিক শক্তি বৈদ্যুতিক শক্তিতে রূপান্তরিত হয়, তাকে তড়িৎ—রাসায়নিক কোষ বা গ্যালভানিক সেল বলা হয় ৷
ইটালির বৈজ্ঞানিক ভোল্টার (Count Volta) নামানুসার একে ভোল্টার কোষও বলা হয়। সকল ধরনের রাসায়নিক বিক্রিয়া হতে সরাসরি বিদ্যুৎ উৎপাদন করা যায় না। শুধুমাত্র জারণ-বিজারণ বিক্রিয়া হতে বিদ্যুৎ উৎপাদন করা যায়; কেননা এ সময় ইলেকট্রনের আদান-প্রদান ঘটে আর বিদ্যুৎ হচ্ছে ইলেকট্রনের প্রবাহ।
গঠন (Construction):
ডেনিয়েল (Daniell) কোষ : একটি বিকারে ZnSO4 এর মোলার দ্রবণ নিয়ে একটি জিংক (Zn) ধাতুর পাতকে ঐ দ্রবণে আংশিক ডুবিয়ে রাখা হয় যা ঋণাত্মক তড়িৎদ্বার বা অ্যানোড । আর একটি বিকারে CuSO4 এর মোলার দ্রবণ নিয়ে তার মধ্যে Cu ধাতুর একটি পাতকে আংশিক ডুবিয়ে রাখা হয় যা ধনাত্মক তড়িৎদ্বার বা ক্যাথোড বলা হয়। এখন Zn ও Cu এর পাত দুটিকে একটি বিভব পার্থক্য মাপার যন্ত্র, পোটেনসিওমিটারের মাধ্যমে পরিবাহী তার দিয়ে যুক্ত করা হয়। অতঃপর দুইটি বিকারের দ্রবণদ্বয়কে সল্ট ব্রিজের মাধ্যমে সংযোগ করলে ডেনিয়েল সেল গঠিত হয়। আবার একটি পাত্রেও ডেনিয়েল সেল তৈরি করা যায়। সে ক্ষেত্রে পাত্রটিকে একটি ছিদ্রবিশিষ্ট মেমব্রেন কাগজ (Porous membrane paper) দ্বারা দুই ভাগে ভাগ করে পূর্বের মতো দ্রবণ ও ধাতুর পাতকে ধাতব তার দিয়ে সংযোগ করে ডেনিয়েল সেল তৈরি করা হয়।
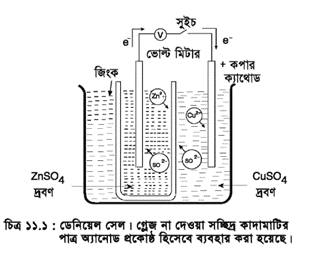
এক্ষেত্রে নিম্নোক্ত বিক্রিয়া সংঘটিত হয় এবং ইলেকট্রন নির্গত হয়।
Zn(s) → Zn2+(aq) + 2e– (জারণ) ………………………………………….(i)
ইলেকট্রন তার দিয়ে কপার দণ্ডে যায় এবং কপার সালফেট দ্রবণের কপার আয়ন এ ইলেকট্রনকে গ্রহণ করে ধাতব কপারে রূপান্তরিত হয় এবং কপার দণ্ডের গায়ে লেগে যায় ৷
Cu2+(aq) + 2e– → Cu(s) (বিজারণ) ………………………………………….(ii)
সুতরাং (i) +(ii) করে কোষে সামগ্রিকভাবে নিম্নোক্ত বিক্রিয়া সংঘটিত হয়।
Zn + Cu2+ = Zn2+ + Cu
এ বিক্রিয়ার শক্তিই বিদ্যুৎ প্রবাহে রূপান্তরিত হয়। বিদ্যুৎ প্রবাহের সময় জিংক দণ্ড ক্ষয়প্রাপ্ত হয়, অন্যদিকে কপার দণ্ড ক্রমশ বৃদ্ধি পায়।
কোষ-৩ একটি তড়িৎ-রাসায়নিক কোষ (Electrochemical cell) এর গঠন বিক্রিয়া নিম্নরুপ:
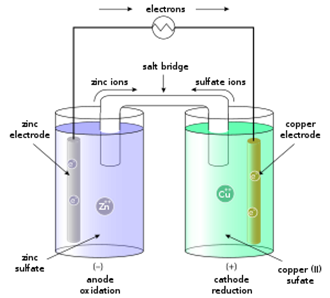
ক্রিয়াকৌশল (Mechanism): একটি ধাতুর তার দ্বারা কপার ও জিংক ধাতুর দণ্ডদ্বয়কে সংযোগ করানো হলে তারের মধ্য দিয়ে জিংক দণ্ড হতে কপার দণ্ডের দিকে ইলেকট্রন প্রবাহিত হবে। এক্ষেত্রে কপার দণ্ড ধনাত্মক তড়িৎদ্বার বা ক্যাথোড এবং জিংক দণ্ড ঋণাত্মক তড়িৎদ্বার বা অ্যানোড হিসেবে কাজ করবে। এ সময়ে নিম্নোক্ত বিক্রিয়াসমূহ সংঘটিত হয়-
জিংক দণ্ড হতে জিংক দ্রবীভূত হয় এবং এসময়ে দু’টি ইলেকট্রন নির্গত হয়,
Zn(s) → Zn2+(aq) + 2e– (জারণ) ………………………………………….(i)
ইলেকট্রনদ্বয় তার দিয়ে কপার দণ্ডের দিকে যায় এবং বিকারের সালফেট দ্রবণের Cu2+ আয়ন এ দুটো ইলেকট্রন গ্রহণ করে ধাতব কপার হিসেবে দণ্ডের গায়ে লেগে যায়।
Cu2+(aq) + 2e– → Cu(s) (বিজারণ) ………………………………………….(ii)
(i) +(ii) করে –
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
এই রাসায়নিক বিক্রিয়ার ফলে ইলেকট্রন মুক্ত হয়ে চলাচলের মাধ্যমে বিদ্যুৎ উৎপন্ন করে। এক্ষেত্রে ইলেকট্রন যেদিকে প্রবাহিত হয় তড়িৎ প্রবাহ তার বিপরীত দিকে ঘটে।
এই বিক্রিয়ার শক্তিই বিদ্যুৎ শক্তিতে রূপান্তরিত হয়। বিদ্যুৎ প্রবাহের সময় জিংক দণ্ড ক্ষয়প্রাপ্ত হয়। অন্যদিকে, কপার দণ্ড ক্রমশ পুরু হয় এবং জিংকের দ্রবণে Zn2+ আয়নের ঘনমাত্রা বাড়তে থাকে এবং CuSO4 দ্রবণে Cu2+আয়নের ঘনমাত্রা কমতে থাকে।
(i) উভয় কোষে-অ্যানোড পাত্রে জিংকের দ্রবণে Zn2+ আয়নের ঘনমাত্রা বাড়তে থাকে এবং ক্যাথোড পাত্রে Cu2+ আয়নের ঘনমাত্রা কমতে থাকে। উভয় কোষ হতে নিরবিচ্ছন্ন তড়িৎ প্রবাহ পেতে হলে অ্যানোড পাত্রে জিংকের দ্রবণে Zn2+ আয়নের ঘনমাত্রা কমানোর জন্য বিপরীত আধান (SO42-, NO31-, Cl–, CO32-) সরবরাহের প্রয়োজন এবং ক্যাথোড পাত্রে Cu2+ আয়নের ঘনমাত্রা বাড়ানোর ক্যাটায়ন(K+, Na+, Ca2+) সরবরাহের প্রয়োজন। কোষ-২ এ লবণ সেতুর পরিবর্ত গ্লেজ না দেওয়া কাদামাটির পাত্র ব্যাবহার করা হয়েছে যা দ্বারা অ্যানোড ও ক্যাথোড পাত্রে Zn2+ ও Cu2+ আয়নের ঘনমাত্রার সাম্যবস্থা নিরবিচ্ছন্ন ভাবে রক্ষা করা সম্ভব না।
অপর পক্ষে, কোষ-৩ এ লবণ সেতুর ব্যাবহার করার অ্যানোড ও ক্যাথোড পাত্রে Zn2+ ও Cu2+ আয়নের ঘনমাত্রার সাম্যবস্থা নিরবিচ্ছন্ন ভাবে রক্ষা করা সম্ভব।
(ii) কোষ-২ এ উভয় দ্রবণের আয়তন সমান হওয়া বাঞ্ছনীয় কিন্তু কোষ-৩ ত্ররুপ কোন সমস্যা নেই।
সর্বোপরি কোষ-২ এবং কোষ-৩ এর মধ্যে কোষ-৩ তড়িৎ উৎপাদনে অধিক কার্যকর।
(h) নং প্রশ্নের উত্তর:-
কপার বিশুদ্ধকরণ (Refining of copper) : তড়িৎ বিশ্লেষণের সাহায্যে বিভিন্ন ধাতব পদার্থকে (যেমন, স্বর্ণ, রৌপ্য, তামা, দস্তা ইত্যাদি) বিশোধন করা যায়। এদের মধ্যে বৈদ্যুতিক কাজে তামার ব্যবহার অত্যন্ত ব্যাপক। এজন্য অতি বিশুদ্ধ তামার প্রয়োজন।
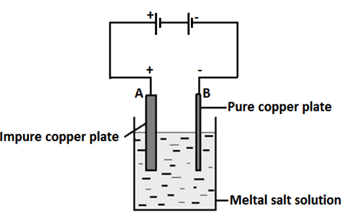
তড়িৎ বিশ্লেষণের সাহায্যে অবিশুদ্ধ তামাকে বিশুদ্ধ তামায় পরিণত করা যায়। এক্ষেত্রে তড়িৎ কোষের ক্যাথোডে বিশুদ্ধ তামার পাত এবং অ্যানোডে অবিশুদ্ধ তামার শীট ব্যবহার করা হয়। অতঃপর তড়িৎ কোষে লঘু H2SO4 মিশ্রিত CuSO4 দ্রবণ নিয়ে তড়িৎপ্রবাহ চালনা করলে অ্যানোড থেকে তামা এবং অন্যান্য ধাতু (দস্তা, লৌহ প্রভৃতি) জারিত হয়ে আয়ন হিসেবে দ্রবণে চলে আসে। এদের মধ্যে Cu2+ আয়ন ক্যাথোডের দিকে ধাবিত হয় এবং ক্যাথোডের সংস্পর্শে পৌছামাত্র ইলেকট্রন গ্রহণ করে (বিজারণ) ক্যাথোডের গায়ে জমা হয়।
বিক্রিয়া : CuSO4 ↔ Cu2+ + SO42-
অ্যানোডে জারণ : Cu → Cu2+
ক্যাথোডে বিজারণ : Cu2+ + 2e → Cu (বিশুদ্ধ)
তড়িৎপ্রলেপন (Electroplating) : তড়িৎ বিশ্লেষণের সাহায্যে কোনো ধাতুর ওপর অন্য কোনো ধাতুর আবরণ দেয়ার প্রক্রিয়াকে তড়িৎপ্রলেপন (electroplating) বলে।
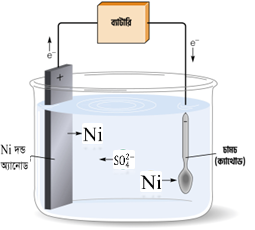
বাতাসের অক্সিজেন বা জলীয়বাষ্পের সাথে ক্রিয়াশীল ধাতুর তৈরি সামগ্রী অথবা অপেক্ষাকৃত সস্তা ও ক্ষয়যোগ্য ধাতু তৈরি সামগ্রীর ওপর এ প্রক্রিয়ার সাহায্যে নিকেল বা ক্রোমিয়ামের প্রলেপ দেয়া হয়। নিষ্ক্রিয় পদার্থের প্রলেপের ফলে বস্তুটির সৌন্দর্য বৃদ্ধি পায় এবং স্থায়ীত্ব লাভ করে।
যে ধাতুর দ্বারা প্রলেপ দিতে হয় তার লবণের দ্রবণে একই ধাতুর দণ্ড অ্যানোড হিসেবে ব্যবহার করতে হয়। যে ধাতুর ওপর প্রলেপ দিতে হবে তাকে ঐ দ্রবণে ডুবিয়ে ব্যাটারির ঋণাত্মক প্রান্তের সঙ্গে যুক্ত করে তড়িৎ প্রবাহ চালাতে হয়। ফলে দ্রবণের ধাতব ক্যাটায়ন ক্যাথোডের সংস্পর্শে গিয়ে ক্যাথোডের গায়ে জমা হয়ে প্রলেপ সৃষ্টি করে। দ্রবণের সাম্যতা রক্ষার জন্য অ্যানোড থেকে সমপরিমাণ ধাতব অণু জারিত হয়ে আয়ন হিসেবে দ্রবণে আসে। এভাবে তড়িৎপ্রলেপন প্রক্রিয়া চলাকালে দ্রবণে ক্যাটায়নে ঘনমাত্রা স্থির থাকে।
উদাহরণস্বরূপ, লোহার চামচের ওপর নিকেলের প্রলেপ দেয়া হয়। এ জন্য তড়িৎ কোষে লঘু H2SO4 মিশ্রিত NiSO4 দ্রবণ নিয়ে তাতে নিকেল দণ্ডকে অ্যানোড এবং লোহার চামচকে ক্যাথোড হিসেবে ব্যবহার করা হয়।
বিক্রিয়া : NiSO4 ↔ Ni2+ + SO42-
অ্যানোডে জারণ : Ni – 2e → Ni2+
ক্যাথোডে বিজারণ : Ni2+ + 2e → Ni (প্ৰলেপ)