ডেনিয়েল সেলের গঠন ও ক্রিয়াকৌশল নিম্নে বর্ণনা করা হলো-
গঠন (Construction): একটি বিকারে ZnSO4 এর মোলার দ্রবণ নিয়ে একটি জিংক (Zn) ধাতুর পাতকে ঐ দ্রবণে আংশিক ডুবিয়ে রাখা হয় যা ঋণাত্মক তড়িৎদ্বার বা অ্যানোড । আর একটি বিকারে CuSO4 এর মোলার দ্রবণ নিয়ে তার মধ্যে Cu ধাতুর একটি পাতকে আংশিক ডুবিয়ে রাখা হয় যা ধনাত্মক তড়িৎদ্বার বা ক্যাথোড বলা হয়। এখন Zn ও Cu এর পাত দুটিকে একটি বিভব পার্থক্য মাপার যন্ত্র, পোটেনসিওমিটারের মাধ্যমে পরিবাহী তার দিয়ে যুক্ত করা হয়। অতঃপর দুইটি বিকারের দ্রবণদ্বয়কে সল্ট ব্রিজের মাধ্যমে সংযোগ করলে ডেনিয়েল সেল গঠিত হয়। আবার একটি পাত্রেও ডেনিয়েল সেল তৈরি করা যায়।
সে ক্ষেত্রে পাত্রটিকে একটি ছিদ্রবিশিষ্ট মেমব্রেন কাগজ (Porous membrane paper) দ্বারা দুই ভাগে ভাগ করে পূর্বের মতো দ্রবণ ও ধাতুর পাতকে ধাতব তার দিয়ে সংযোগ করে ডেনিয়েল সেল তৈরি করা হয়।
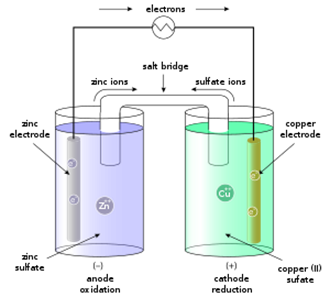
ক্রিয়াকৌশল (Mechanism): একটি ধাতুর তার দ্বারা কপার ও জিংক ধাতুর দণ্ডদ্বয়কে সংযোগ করানো হলে তারের মধ্য দিয়ে জিংক দণ্ড হতে কপার দণ্ডের দিকে ইলেকট্রন প্রবাহিত হবে। এক্ষেত্রে কপার দণ্ড ধনাত্মক তড়িৎদ্বার বা ক্যাথোড এবং জিংক দণ্ড ঋণাত্মক তড়িৎদ্বার বা অ্যানোড হিসেবে কাজ করবে। এ সময়ে নিম্নোক্ত বিক্রিয়াসমূহ সংঘটিত হয়-
জিংক দণ্ড হতে জিংক দ্রবীভূত হয় এবং এসময়ে দু’টি ইলেকট্রন নির্গত হয়,
Zn(s) → Zn2+(aq) + 2e– (জারণ) ………………………………………….(i)
ইলেকট্রনদ্বয় তার দিয়ে কপার দণ্ডের দিকে যায় এবং বিকারের সালফেট দ্রবণের Cu2+ আয়ন এ দুটো ইলেকট্রন গ্রহণ করে ধাতব কপার হিসেবে দণ্ডের গায়ে লেগে যায়।
Cu2+(aq) + 2e– → Cu(s) (বিজারণ) ………………………………………….(ii)
(i) +(ii) করে –
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
এই রাসায়নিক বিক্রিয়ার ফলে ইলেকট্রন মুক্ত হয়ে চলাচলের মাধ্যমে বিদ্যুৎ উৎপন্ন করে। এক্ষেত্রে ইলেকট্রন যেদিকে প্রবাহিত হয় তড়িৎ প্রবাহ তার বিপরীত দিকে ঘটে।
এই বিক্রিয়ার শক্তিই বিদ্যুৎ শক্তিতে রূপান্তরিত হয়। বিদ্যুৎ প্রবাহের সময় জিংক দণ্ড ক্ষয়প্রাপ্ত হয়। অন্যদিকে, কপার দণ্ড ক্রমশ পুরু হয় এবং জিংকের দ্রবণে Zn2+আয়নের ঘনমাত্রা বাড়তে থাকে এবং CuSO4 দ্রবণে Cu2+আয়নের ঘনমাত্রা কমতে থাকে।
প্রশ্ন: লবণ সেতু কী? তড়িৎ রাসায়নিক কোষে লবণ সেতু ব্যবহার করা হয় কেন?
প্রশ্ন: লবণ সেতু কী? কোষে লবণ সেতুর ভূমিকা কী?
লবণ সেতু (Salt bridge) : দুইটি তড়িৎদ্বারের মাঝে পরোক্ষ সংযোগ স্থাপনের জন্য তীব্র তড়িৎবিশ্লেষ্য লবণ (NaCl, Na2SO4, NaNO3 KCl, NH4Cl প্রভৃতি) এর 0.1 M ঘনমাত্রার দ্রবণপূর্ণ যে বাঁকা কাচ নল [উল্টা U আকৃতি] ব্যবহার করা হয়, তাকে লবণ সেতু বলে। লবণ সেতুর দুই মুখে তুলা দ্বারা ভর্তি থাকে। লবণ সেতুর দু’বাহুর বা দু’প্রান্ত দুটি অর্ধকোষে ডুবানো থাকে। দুইটি তড়িৎদ্বারকে লবণ সেতু দ্বারা সংযোগ বুঝানোর জন্য “||” চিহ্ন ব্যবহার করা হয়।
যেমন, ডেনিয়েল কোষের Zn |Zn2+ এবং Cu2+ | Cu তড়িৎদ্বারের মাঝে পরোক্ষ সংযোগ বোঝানোর জন্য লবণ সেতুর ব্যবহার দেখানো হলো-
Zn |Zn2+ || Cu2+ | Cu
লবণ সেতুর গুরুত্ব :
১. দুইটি তড়িৎদ্বারের মাঝে পরোক্ষ সংযোগ স্থাপনকরে।
২. প্রতিটি তড়িৎদ্বারে বিপরীত আয়নের ঘাটতি পূরণ করে।
৩. দুটি অর্ধকোষের দ্রবণের মধ্যে তড়িৎ নিরপেক্ষতা বজায় রাখে।
লবণ সেতুর বৈশিষ্ট্য :
১. লবণ সেতুতে রাখা তড়িৎবিশ্লেষ্যের ক্যাটায়ন ও অ্যানায়নের গতিবেগ সমান (বা প্রায় সমান) হবে।
২. গ্যালভানিক কোষ রিডক্স বিক্রিয়া দেয়- ব্যাখ্যা করো।
২. তড়িৎবিশ্লেষ্যটি কোষের দ্রবণ দুটির সঙ্গে কোনো বিক্রিয়া করবে না। যেমন: ডেনিয়েল কোষের (উপরের চিত্রে) অ্যানোডের জিংক ক্ষয়প্রাপ্ত হয়ে Zn2+ দ্রবণে চলে আসায় Zn2+ আয়ন এর আধিক্য দেখা যায়, তখন লবণ সেতু হতে বিপরীত আয়ন (SO42-) এসে চার্জের সমতাবিধান করে জিংকের ক্ষয় অব্যাহত রাখে। অন্যদিকে, উক্ত কোষের ক্যাথোডে দ্রবণ হতে Cu2+ দুইটি ইলেকট্রন গ্রহণ করে কপার দণ্ডে জমা হয়, এর ফলে দ্রবণে ধনাত্মক আয়নের ঘাটতি দেখা যায়; লবণ সেতু বিপরীত আয়ন (Na+) সরবরাহ করে চার্জের সমতাবিধান করে ক্যাথোডে Cu2+ এর জমা হওয়ার প্রক্রিয়াকে অব্যাহত রাখে।
৩. সর্বোপরি লবণ সেতু কোষের বর্তনীপূর্ণ করে তড়িৎপ্রবাহ অক্ষুণ্ণ রাখে।