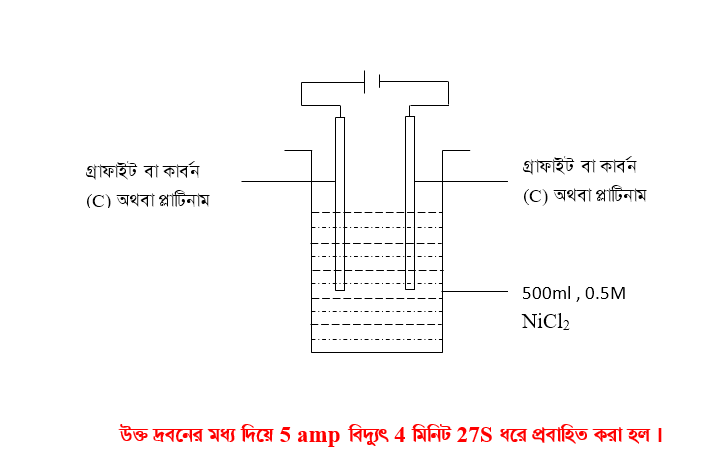
ক) তড়িৎ বিশ্লেষনের পরে দ্রবণের ঘনমাত্রা কত ?
খ) দ্রবণ থেকে ক্যাথডে সঞ্চিত নিকেলর ভর/মোলসংখ্যা/অণুর সংখ্যা কত ?
গ) দ্রবনের অবশিষ্ট নিকেল আয়ন ক্যাথডে জমা করতে কত কুলম্ব চার্জ প্রবাহিত করতে হবে ।
ঘ) দ্রবণ হতে সমস্ত নিকেল আয়ন অপসারনের জন্য একই তড়িৎ কতক্ষন ধরে প্রবাহিত করতে হরে ?
ঙ) দ্রবনের অবশিষ্ট ক্লোরাইড আয়ন অ্যানোড জমা করতে কত কুলম্ব চার্জ প্রবাহিত করতে হবে ।
চ) অ্যানোডে উৎপন্ন ক্লোরিন পরিমান কত ?
ক নং প্রশ্নের উত্তর – তড়িৎ বিশ্লেষনের পরে দ্রবণের ঘনমাত্রা নির্ণয়
তড়িৎ বিশ্লেষনের আগে পাত্রের দ্রবণটিতে NiCl2 ভর –
আমরা জানি-
$$S\;=\;\frac{1000w}{MV}$$
$$or,\;1000W\;=\;SMV$$
$$or,\;w\;=\;\frac{SMV}{1000}$$
$$or,\;w\;=\;\frac{0.5\times129.59\times500}{1000}$$
$$or,\;w\;=\;32.39\;g$$
ক্যাথোডে সঞ্চিত নিকেলের ভর= 0.405 g
এখানে,
NiCl2 এর আনবিক ভর , M = 129.59 g
দ্রবণটির ঘনমাত্রা, S = 0.5M
দ্রবণটির আয়তন, V = 500 mL
NiCl2 প্রদত্ত ভর, W = ?
NiCl2 → Ni2+ + 2Cl
তড়িৎ বিশ্লেষনের পরে ক্যাথডে সঞ্চিত Ni2+ তথা Ni এর ভর –
Ni2+ + e– → Ni
$$W_1\;=\frac{MIt}{eF}\;$$
$$or,\;W_1\;=\frac{58.69\times5\times267}{2\times96500}$$
$$or,\;W_1\;=\;0.405\;g$$
এখানে,
Ni এর আনবিক ভর, M = 58.69 g
দ্রবণটিতে প্রবাহিত তড়িৎ, I = 5 A
তড়িৎ প্রবাহের সময়, t = (4×60 + 27) S
= 267 S
Ni2+ তথা Ni এর যোজনী, n = 2
1F = 96500C সঞ্চিত Ni2+ তথা Ni ভর, W =?
তড়িৎ বিশ্লেষনের পরে অ্যানোডে সঞ্চিত Cl– তথা Cl2এর ভর –
2Cl– – 2e– → Cl2
আমরা জানি-
$$W_2\;=\frac{MIt}{eF}\;$$
$$or,\;W_2\;=\frac{70.90\times5\times267}{2\times96500}$$
$$or,\;W_2\;=\;0.490\;g$$
এখানে,
Cl2 এর আনবিক ভর, M = 70.9 g
দ্রবণটিতে প্রবাহিত তড়িৎ, I = 5 A
তড়িৎ প্রবাহের সময়, t = (4×60 + 27) S
= 267 S
Cl– তথা Cl এর যোজনী, n = 2
1F = 96500C
সঞ্চিত Cl– তথা Cl2 ভর, W =?
দ্রবনে আবশিষ্ট NiCl2 এর ভর ∆w = {w – (w1 + w2)}g
= {32.39 – (0.405 + 0.490)}g
= 31.495 g
তড়িৎ বিশ্লেষনের পরে দ্রবনে আবশিষ্ট NiCl2 এর ঘনমাত্রা –
আমরা জানি-
$$S\;=\;\frac{1000\;∆w}{MV}$$
$$or,\;\;S\;=\;\frac{1000\times31.495}{129.59\times500}$$
$$or,\;w\;=\;0.48M\;$$
তড়িৎ বিশ্লেষনের পরে পাত্রের দ্রবণটিতে = 0.48 M
এখানে,
NiCl2 এর আনবিক ভর , M = 129.59 g
দ্রবণে অবশিষ্ট NiCl2 এর ভর, ∆w = 31.495 g
দ্রবণটির আয়তন, V = 500 mL
NiCl2 দ্রবণের পরিবর্তিত ঘনমাত্রা, S = ?
বিকল্প নিয়ম – ক নং প্রশ্নের উত্তর – তড়িৎ বিশ্লেষনের পরে দ্রবণের ঘনমাত্রা নির্ণয়
তড়িৎ বিশ্লেষনের আগে পাত্রের দ্রবণটিতে NiCl2 এর পারিমাণ –
আমরা জানি-
n = SV
বা, n = 0.5 × 0.5
বা, n = 0.25 mol
এখানে,
NiCl2 এর আনবিক ভর , M = 129.59 g
দ্রবণটির ঘনমাত্রা, S = 0.5M
দ্রবণটির আয়তন, V = 500 mL = 0.5 L
দ্রবণে NiCl2 মোল সংখ্যা, n = ?
প্রবাহিত তড়িৎ ,
Q = It
বা, Q = (4 × 267) C
বা, Q = 1068 C
এখানে,
তড়িৎ প্রবাহ, I = 5 amp
তড়িৎ প্রবাহের সময়, t = (4×60 + 27) S
= 267 S
তড়িৎ বিশ্লেষনের পরে ক্যাথডে সঞ্চিত NiCl2এর পারিমাণ –
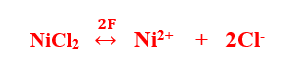
2 × 9500 C বিদ্যুৎ প্রবাহে সঞ্চিত NiCl2 = 1 mol
1068 C ” ” ” NiCl2 = (1×1068) ÷ (2 × 96500)
= 0.0055 mol
দ্রবনে আবশিষ্ট NiCl2 এর ভর ∆n = (0.25 – 0.0055) mol
= 0.2445 mol
$$\triangle n\;\;=\;\;SV$$
$$or,\;S\;\;=\;\frac{\triangle n}V$$
$$or,\;S\;=\frac{0.2445}{0.5}$$
$$or,\;,\;S\;\;=\;\;0.48\;M$$
তড়িৎ বিশ্লেষনের পরে পাত্রের দ্রবণটিতে = 0.48 M
এখানে,
দ্রবণটির ঘনমাত্রা, S = 0.5M
দ্রবণটির আয়তন, V = 500 mL
= 0.5 L
দ্রবণটির ঘনমাত্রা, S = ?
খ নং প্রশ্নের উত্তর – ক্যাথডে সঞ্চিত নিকেলের ভর নির্ণয়:
তড়িৎ বিশ্লেষনের পরে ক্যাথডে সঞ্চিত Ni2+ তথা Ni এর ভর –
Ni2+ + e– → Ni
আমরা জানি-
$$W_1\;=\frac{MIt}{eF}\;$$
$$or,\;W_1\;=\frac{58.69\times5\times267}{2\times96500}$$
$$or,\;W_1\;=\;0.405\;g$$
ক্যাথোডে সঞ্চিত নিকেলের ভর= 0.405 g
এখানে,
Ni এর আনবিক ভর, M = 58.69 g
দ্রবণটিতে প্রবাহিত তড়িৎ, I = 5 A
তড়িৎ প্রবাহের সময়, t = (4×60 + 27) S
= 267 S
Ni2+ তথা Ni এর যোজনী, n = 2
1F = 96500C সঞ্চিত Ni2+ তথা Ni ভর, W =?
খ নং প্রশ্নের উত্তর – ক্যাথডে সঞ্চিত নিকেলের মোল সংখ্যা নির্ণয়
আমরা জানি –
$$n\;\;\;\;=\;\;\;\frac wM$$
$$or,\;n\;\;\;\;=\;\;\;\frac{0.405}{58.69}$$
$$or,\;n\;\;=\;0.0069\;mol$$
ক্যাথোডে সঞ্চিত নিকেলের মোল,n = 0.0069 mol
এখানে,
Ni এর আনবিক ভর, M = 58.69 g
ক্যাথোডে সঞ্চিত নিকেলের ভর, w = 0.405 g
মোল,n =?
খ নং প্রশ্নের উত্তর – ক্যাথডে সঞ্চিত নিকেলের অণুর সংখ্যা নির্ণয়
আমরা জানি –
$$\frac wM\;\;\;=\;\;\frac N{N_A}$$
$$or,\;N\;\;\;=\;\;\frac{w\times N_A}N$$
$$or,\;N\;\;\;=\;\;\frac{0.405\times{6.023\times10}^{23}}{58.69}$$
$$or,\;N=\;4.15\times10^21$$
ক্যাথোডে সঞ্চিত অণুর সংখ্যা = 4.15×1021 টি
এখানে,
Ni এর আনবিক ভর, M = 58.69 g
ক্যাথোডে সঞ্চিত নিকেলের ভর, w = 0.405 g
অ্যাভোগ্যাড্রো সংখ্যা, NA = 6..023×1023 টি
অণুর সংখ্যা, N =
গ নং প্রশ্নের উত্তর – অবশিষ্ট নিকেল আয়ন ক্যাথডে জমা করতে প্রবাহিত চার্জ নির্ণয়
NiCl2 → Ni2+ + 2Cl–
গ) দ্রবনে আবশিষ্ট NiCl2এর ভর = 31.495 g
আমরা জানি,
$$W\;=\;ZQ$$
$$or,\;W\;=\;{\textstyle\frac M{nF}}\times Q$$
$$or,\;MQ\;=\;WnF$$
$$or,\;\;Q\;={\textstyle\frac{WnF}M}$$
$$or,\;Q\;={\textstyle\frac{10.498\;\times\;2\;\times\;96500\;}{58.69}}$$
$$or,\;Q\;=\;34522.3036\;C$$
দ্রবনে আবশিষ্ট Ni2+ ক্যাথোডে জমা করতে চার্জ প্রবাহিত করতে হয়= 34522.3036 C
এখানে,
Ni2+ এর আনবিক ভর , M = 58.69 g
দ্রবণে আবশিষ্ট Ni2+ এর ভর, W = ( 1/3 × 31.495) g
= 10.498 g
Ni2+ এর যোজনী, n = 2
1F = 96500C
দ্রবণের আবশিষ্ট Ni2+ ক্যাথডে সঞ্চিত করতে প্রবাহিত তড়িৎ, Q = ?
ঘ নং প্রশ্নের উত্তর – অবশিষ্ট নিকেল আয়ন অপসারনের জন্য একই তড়িৎ কতক্ষন ধরে প্রবাহিত করতে হবে তা নির্ণয়
Ni2+ + e– → Ni
আমরা জানি-
$$W\;=\;\frac{MIt}{nF}$$
$$or,\;MIt\;=\;nFW$$
$$or,\;t\;=\frac{nFW}{MI}$$
$$or,\;t\;=\frac{2\;\times\;96500\;\times\;10.498}{(58.69\;\times\;5)}$$
$$or,\;t\;=\;6904.460\;Sec$$
দ্রবনে আবশিষ্ট Ni2+ ক্যাথোডে জমা করতে ব্যায়িত সময় = 6904.460 Sec
এখানে,
Ni2+ এর আনবিক ভর , M = 58.69 g
দ্রবণে আবশিষ্ট Ni2+ এর ভর, W = ( 1/3 × 31.495) g
= 10.498 g
Ni2+ এর যোজনী, n = 2
1F = 96500C
দ্রবণের আবশিষ্ট Ni2+ ক্যাথডে সঞ্চিত করতে প্রবাহিত তড়িৎ, Q = ?
ঙ নং প্রশ্নের উত্তর – অবশিষ্ট ক্লোরাইড আয়ন অ্যানোড জমা করতে কত কুলম্ব চার্জ প্রবাহিত করতে হবেতা নির্ণয়
NiCl2 → Ni2+ + 2Cl–
আমরা জানি,
$$W\;=\;ZQ$$
$$or,\;W\;=\;{\textstyle\frac M{nF}}\times Q$$
$$or,\;MQ\;=\;WnF$$
$$or,\;\;Q\;={\textstyle\frac{WnF}M}$$
$$or,\;Q\;={\textstyle\frac{20.996 \;\times\;1\;\times\;96500\;}{58.69}}$$
$$or,\;Q\;=\;34522.303 C\;C$$
দ্রবনে আবশিষ্ট Cl– অ্যানোডে জমা করতে চার্জ প্রবাহিত করতে হয়= 34522.303 C
এখানে,
Ni2+ এর আনবিক ভর , M = 58.69 g
দ্রবণে আবশিষ্ট Ni2+ এর ভর, W = ( 2/3 × 31.495) g
= 20.996 g
Ni2+ এর যোজনী, n = 2
1F = 96500C
দ্রবণের আবশিষ্ট Ni2+ ক্যাথডে সঞ্চিত করতে প্রবাহিত তড়িৎ, Q = ?
চ নং প্রশ্নের উত্তর – অ্যানোডে উৎপন্ন ক্লোরিন পরিমান নির্ণয়
তড়িৎ বিশ্লেষনের পরে অ্যানোডে সঞ্চিত Cl– তথা Cl2এর ভর –
2Cl– – 2e– → Cl2
আমরা জানি-
$$W_2\;=\frac{MIt}{eF}\;$$
$$or,\;W_2\;=\frac{70.90\times5\times267}{2\times96500}$$
$$or,\;W_2\;=\;0.490\;g$$
অ্যানোড তড়িৎদ্বারে উৎপন্ন এর ভর= 0.4911 g
এখানে,
Cl2 এর আনবিক ভর, M = 70.9 g
দ্রবণটিতে প্রবাহিত তড়িৎ, I = 5 A
তড়িৎ প্রবাহের সময়, t = (4×60 + 27) S
= 267 S
Cl– তথা Cl এর যোজনী, n = 2
1F = 96500C
সঞ্চিত Cl– তথা Cl2 ভর, W =?
চ নং প্রশ্নের উত্তর – অ্যানডে উৎপন্ন Cl2 এর মোল সংখ্যা নির্ণয়
আমরা জানি –
$$n\;\;\;\;=\;\;\;\frac wM$$
$$or,\;n\;\;\;\;=\;\;\;\frac{0.491}{71}$$
$$or,\;n\;\;=\;0.0069\;mol$$
অ্যানোডে সঞ্চিত Cl2 এর মোল = 0.0069 mol
এখানে,
Cl2 এর আনবিক ভর, M = 71 g
অ্যানোডে সঞ্চিত Cl2 ভর, w = 0.491 g
মোল, n = ?
চ নং প্রশ্নের উত্তর – অ্যানডে উৎপন্ন Cl2 এর অণুর সংখ্য নির্ণয়
আমরা জানি –
$$\frac wM\;\;\;=\;\;\frac N{N_A}$$
$$or,\;N\;\;\;=\;\;\frac{w\times N_A}N$$
$$or,\;N\;\;\;=\;\;\frac{0.491\times{6.023\times10}^{23}}{71}$$
$$or,\;N=\;4.16\times10^21$$
অ্যানোডে সঞ্চিত অণুর সংখ্যা = 4.16×1021 টি
এখানে,
Cl2 এর আনবিক ভর, M = 71 g
অ্যানোডে সঞ্চিত Cl2 ভর, w = 0.491 g
অ্যাভোগ্যাড্রো সংখ্যা, NA = 6..023×1023 টি
অণুর সংখ্যা, N =
ছ নং প্রশ্নের উত্তর – অ্যানডে উৎপন্ন O2 এর আয়তন নির্ণয়
আমরা জানি –
$$\frac wM\;\;=\;\frac V{22.4}$$
$$or,\;N\;\;\;=\;\;\frac{w\times 22.4}M$$
$$or,\;V\;\;\;\;=\;\;\frac{0.4911\;\times\;22.4}{71}$$
$$or,V\;\;\;\;=\;\;0.154\;L$$
অ্যানডে উৎপন্ন Cl2 এর আয়তন = 0.154 L
এখানে,
Cl2 এর আনবিক ভর, M = 71 g
অ্যানোডে সঞ্চিত Cl2 ভর, w = 0.491 g
Cl2 এর আয়তন , V = ?
উদাহরণ
১. 500ml 0.5M ZnSO4 দ্রবণে 10 মিনিট ধরে 20A তড়িৎ চালনা করা হলো। ক্যাথোডে ধাতু জমা হওয়ার পর দ্রবণের ঘনমাত্রা কত হবে? দ্রবণের অবশিষ্ট ধাতু সম্পূর্ণরূপে ক্যাথোডে সঞ্চিত করতে কত কুলম্ব চার্জ প্রবাহিত করতে হবে? [উত্তর: 0.365M, 3.52 x 104C]
২. 500ml 0.5M CuSO4 দ্রবণে 10 মিনিট ধরে 20A তড়িৎ চালনা করা হলো। ক্যাথোডে ধাতু জমা হওয়ার পর দ্রবণের ঘনমাত্রা কত হবে? দ্রবণের অবশিষ্ট ধাতু সম্পূর্ণরূপে ক্যাথোডে সঞ্চিত করতে কত কুলম্ব চার্জ প্রবাহিত করতে হবে? [উত্তর: 0.365M 3.52 x 104C]
৩. 500ml 0.5M Cr2(SO4)3 দ্রবণে 7 মিনিট ধরে 16A তড়িৎ চালনা করা হলো। ক্যাথোডে ধাতু জমা হওয়ার পর দ্রবণের ঘনমাত্রা কত হবে? দ্রবণের অবশিষ্ট ধাতু সম্পূর্ণরূপে ক্যাথোডে সঞ্চিত করতে কত কুলম্ব চার্জ প্রবাহিত করতে হবে? [উত্তর: 0.365M, 3.52 x 104C]
৪. 1.5L0.25M Al2(SO4)3 দ্রবণে কত কুলম্ব চার্জ প্রবাহিত করলে সবটুকু ধাতু ক্যাথোডে জমা হবে? [উত্তর: 2.17×103C ]
৫. 2L 0.005 M AuCl3 দ্রবণের ক্যাথোডে একটি রূপার চামচ যুক্ত করে মিনিট 10 সেকেন্ড ধরে 0.5A তড়িৎ চালনা করলে রূপার চামচে কয়টি সোনার পরমাণু জমা হবে? [উত্তর: 6.24 ×1020 টি)
৬. 100ml 0.5M H2SO4 দ্রবণে 10 মিনিট ধরে 0.5A তড়িৎ চালনা করলে দ্রবণের ঘনমাত্রা কত হবে? [উত্তর: 0.498M]
৭. 200ml 0.5M HCl দ্রবণে 10 মিনিট ধরে 0.5A তড়িৎ চালনা করলে দ্রবণের ঘনমাত্রা কত হবে? [উত্তর: 0.4845M]